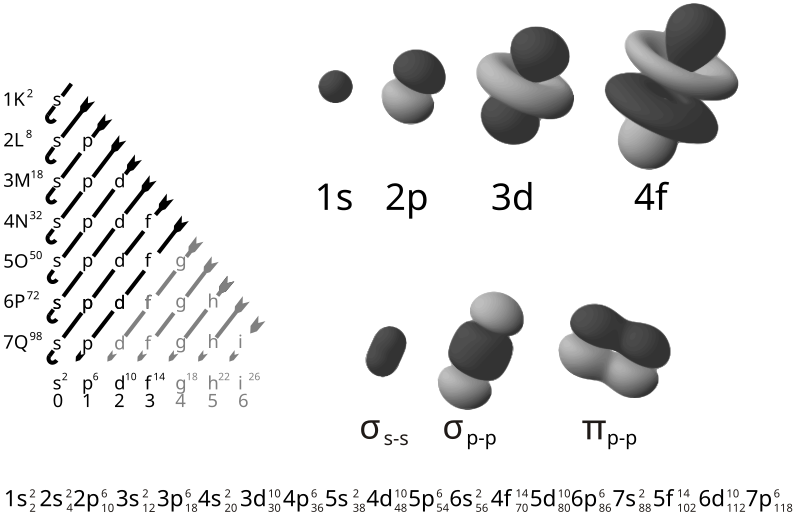
Configuración electrónica: Regla de las diagonales.
La configuración electrónica del átomo de un elemento corresponde a la ubicación de los electrones en los orbitales de los diferentes niveles de energía. Aunque el modelo de Scrödinger es exacto sólo para el átomo de hidrógeno, para otros átomos es aplicable el mismo modelo mediante aproximaciones muy buenas.
La manera de mostrar cómo se distribuyen los electrones en un átomo, es a través de la configuración electrónica. El orden en el que se van llenando los niveles de energía es: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p. El esquema de llenado de los orbitales atómicos, lo podemos tener utilizando la regla de la diagonal, para ello debes seguir atentamente la flecha del esquema comenzando en 1s; siguiendo la flecha podrás ir completando los orbitales con los electrones en forma correcta.
Conclusiones: Este método nos sirve ya que es fácil y practico, para saber el orden de los orbitales a la hora de realizar una configuración electrónica de cierto elemento.